Le applicazioni proprietarie relative all’ecosistema della piattaforma sono:
- ICE® eCRF: Electronic Case Report Form
- ICE® ePRO: Electronic Patient Reported Outcome
- ICE® eTMF: Electronic Trial Master File
- ICE® CTMS: Clinical Trial Management System
Tutte le soluzioni sono dotate di un’interfaccia web-based user-friendly, distribuite come applicazioni SaaS (Software as a Service). L’utente ha solamente bisogno del browser del proprio dispositivo per interagire con la piattaforma. Ogni applicazione è sviluppata con una logica multi-tenant, per una gestione del software centralizzata e condivisa che ottimizza risorse, aggiornamenti e manutenzione per ogni cliente. Lo sviluppo e manutenzione adottano le tecnologie più aggiornate per garantire gli standard di sicurezza (es. OWASP top10).
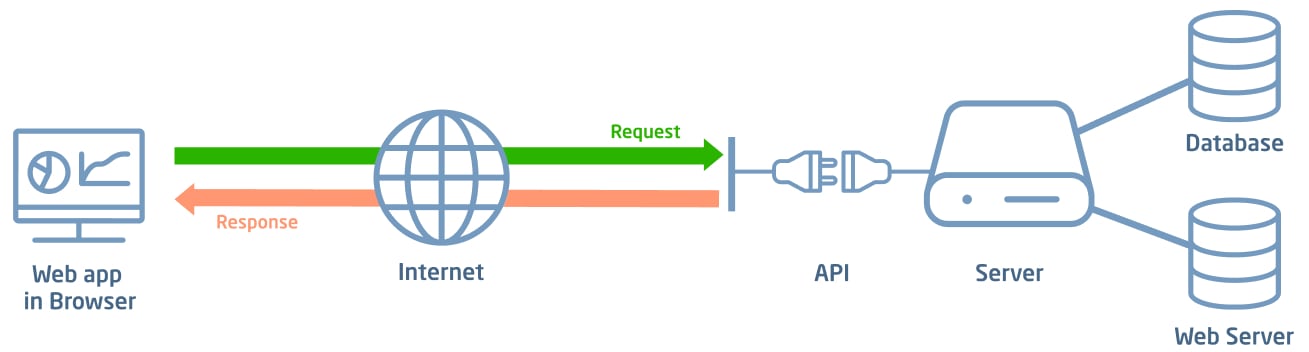
Attività di convalida
Durante l’intero life cycle del sistema, eseguiamo rigorose attività di convalida dei sistemi informatici (CSV/CSA) per garantire che i nostri prodotti soddisfino i più alti standard di qualità e conformità alle normative cogenti (FDA 21 CFR Part 11, Eudralex Vol4 Annex 11 e relative linee guida, nonché GDPR e HIPAA).
Queste attività includono:
- Pianificazione della Convalida: Definiamo un piano dettagliato che descrive gli obiettivi, le risorse e le tempistiche per la convalida del sistema.
- Analisi dei Rischi: Identifichiamo e valutiamo i potenziali rischi associati al sistema per garantire che siano adeguatamente mitigati.
- Test di Convalida: Conduciamo test approfonditi per verificare che il sistema sia installato in sicurezza e funzioni correttamente in tutte le condizioni operative previste.
- Documentazione dettagliata: Manteniamo una documentazione completa e accurata di tutte le attività di convalida, inclusi i risultati dei test e le eventuali azioni correttive. In questo modo permettiamo agli auditor di esaminare ogni aspetto della convalida garantendo trasparenza e conformità .
- Revisione e Approvazione: I risultati della convalida vengono esaminati e approvati da un team di esperti per garantire la conformità alle normative e agli standard aziendali.
- Aggiornamenti: ogni implementazione aggiuntiva al sistema o alle sue configurazioni è tracciata e autorizzata con meccanismo di change management, eseguita, e convalidata in ambiente di test prima del rilascio.
Timeline di sviluppo della piattaforma ICE
OTTOBRE
ICE® eTMF 1.2.0 - Introduzione della visibilità studio e centro specifica per gli utenti.
LUGLIO
ICE® eCRF 3.11.0 - predisposizione ICE® per sviluppi nomenclatura CDASH e ottimizzazione delle prestazioni complessive del sistema.
GIUGNO
ICE® eCRF 3.10.0 - nuova sezione per la gestione del farmaco e Ottimizzazione di Funzionalità esistente.
MAGGIO
Nasce electronic Patient Reported Outcome, ICE® ePRO 1.0.0 - il sistema innovativo web-based convalidato che consente ai pazienti la diretta compilazione dei questionari elettronici, con l’obiettivo di migliorare sia l’assistenza che la reportistica. Grazie a ePRO la raccolta dati sanitari digitali diventa decentralizzata, efficiente e affidabile.
MAGGIO
ICE® eCRF 3.9.0 - modulo ePRO , miglioramenti della funzionalità di audit e eQuery.
GENNAIO
ICE® eTMF 1.1.0 - Implementato il flusso per la chiusura e l’approvazione degli studi; aggiunta funzionalità export dei documenti in base a filtri impostati.
DICEMBRE
ICE® eCRF 3.8.0 - Protocol deviation: nuova sezione per tracciare le query aperte in questo modo.
SETTEMBRE
ICE® eCRF 3.7.0 - IDE/Editor: aggiunto un nuovo componente apibutton, visibile solo tramite permessi; strumenti di amministrazione: nuovo pulsante per abilitare il permesso di visibilità del componente apibutton.
SETTEMBRE
Nasce electronic Trial Master File, ICE® eTMF 1.0.0 - il sistema digitale utilizzato per gestire e archiviare i documenti essenziali di uno studio clinico; sostituisce il tradizionale Trial Master File (TMF) cartaceo, che contiene i documenti necessari per la conduzione delle sperimentazioni cliniche.
MAGGIO
ICE® eCRF 3.6.0 - Ottimizzazione stampa PDF; aggiunta funzionalità di codifica farmaci; aggiunta opzione “Associa tutti i centri” per gli utenti.
FEBBRAIO
ICE® eCRF 3.5.0 - Export SAS: aggiunta nuova funzionalità per l’export dei dati in formato SAS.
NOVEMBRE
ICE® eCRF 3.4.0 - Helpdesk: apertura ticket direttamente da ICE3; event mail: migliorato utilizzo degli eventi “component value”.
OTTOBRE
ICE® eCRF 3.3.0 - Collegamento con Lime Survey di dati clinici.
SETTEMBRE
ICE® eCRF 3.2.0 - URV Grid, aggiunta nuova sezione per visualizzare meglio tutti gli URV compilati di un paziente; importazione dati clinici, introdotto sistema per l’importazione massiva di dati clinici.
LUGLIO
ICE® eCRF 3.1.0 - Audit trail soggetto solo a soft-delete; aggiunta tracciatura del download di file eCRF caricati.
MARZO
Rilascio ICE® eCRF 3.0.0 - Nuova infrastruttura di multi tenancy.
Nasce Clinical Trial Management System, ICE® CTMS 1.0 - che consente anche grazie al dialogo con le eCRF create dalla piattaforma ICE, di ottenere in tempo reale i dati necessari per monitorare il raggiungimento dei KPI delle sperimentazioni cliniche
ICE® eCRF 2.0.0 - Il golive delle prime sperimentazioni cliniche.
Nasce Integrated Clinical Trial Environment, ICE® eCRF 1.0 - La piattaforma EDC per la raccolta e il monitoraggio dei dati clinici, strumento essenziale a supporto delle sperimentazioni cliniche.
